1953年,弗朗西斯·克里克(Francis Crick)在一张纸上用铅笔画出了一条旋转着的螺旋条带。仅仅9年后,他就与詹姆斯·沃森(James Watson)一同获得了诺贝尔生理学或医学奖。
因为他们发现了人类生命的密码——DNA。不过直到去年,学界才承认在DNA发现过程中,另一位女科学家罗莎林德·富兰克林(Rosalind Franklin)应该享有同等的贡献。
不到百年间,我们对DNA和染色体的理解突飞猛进,甚至我刚上小学的侄女都知道人类的生命是由四个不同碱基构成的。
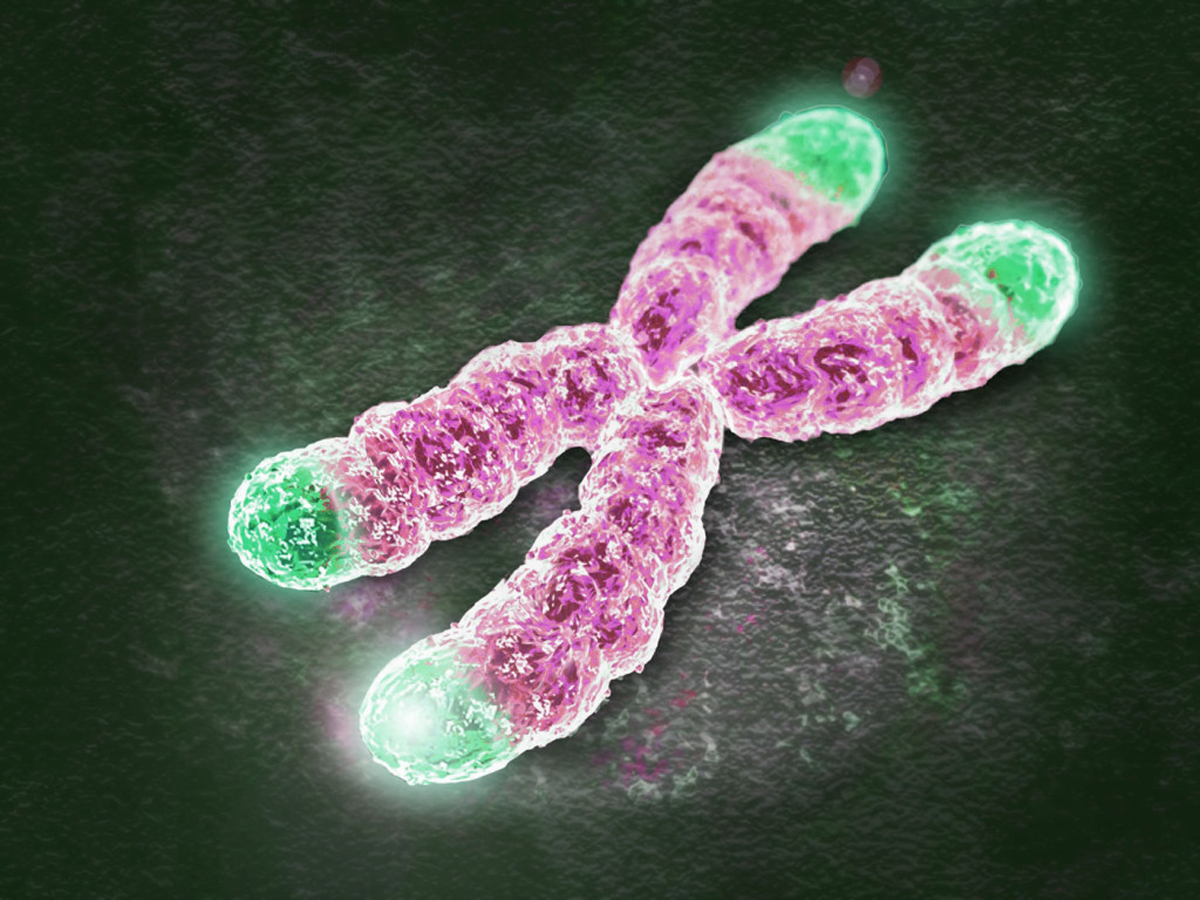
真正的长寿密码似乎也蕴藏在染色体结构的末端——端粒上。 可能会令你意外的是,端粒结构1939年就被科学家命名了,“端粒(telomere)一词”源于希腊文telos(末端)和meros(部分)。
这个染色体末端的小帽子,为什么可以影响我们的寿命?
为什么是端粒?
就在今年,美国科学家伦纳德·海弗里克(Leonard Hayflick)在加州去世,享年96岁。如果说沃森、克里克和富兰克林发现了生命的密码,那海弗里克发现的就是衰老的开关。
1961年,海弗里克发现细胞会在分裂到一定程度后停止分裂——结果当然就是衰老和死亡。1974年,另一位学者将这个现象命名为 “海弗里克极限”。

20世纪70年代,多位科学家在海弗里克极限的理论下,发现端粒——这个真核细胞线状染色体末端的一小段DNA-蛋白质复合体,是细胞程序性死亡的 “元凶” 。
简单来说,端粒就是染色体两端的“帽子”;作用是保持染色体的完整性、维持基因组稳定性和控制细胞分裂周期。
为啥说是“帽子”?首先,端粒本身其实没有任何密码功能,它就像一顶高帽子置于染色体头上。其次,在DNA需要复制的时候,必须先经过端粒(识别端粒序列),端粒确认无误后,其他工具酶才能继续沿着DNA链走下去,复制真正的遗传信息,有“安全帽”的作用。
端粒会让你老,是为了你好
安全帽为什么能影响寿命?那这个安全帽是不是管的有点太多了?
嗯……工地安全员可能不这么想。和安全帽保护工人不被意外伤害一样,端粒让细胞“程序性死亡”也是为了让那些有问题的细胞可以定时“下班”,不要无休止的复制与生长——癌细胞就是那种不下班的“卷王”。
学术上,通常把端粒看作是“细胞生命时钟”,这是因为端粒长度直接影响细胞寿命。作为一种正常的细胞过程,端粒长度会随着体细胞分裂次数的增多而减少,若端粒缩短到一定程度或完全消失后,则会导致细胞衰老、凋亡或癌变[1,3]。
肯定有人想,如果能通过某种手段增加端粒长度,是不是就能“长生不老”了?这就涉及到一个问题,端粒是越长越好吗?
答案当然不是!
美国约翰霍普金斯大学医学院的肿瘤学教授玛丽·阿曼纽斯(Mary Armanios)团队发现,虽然短端粒确实会导致健康问题,但过长的端粒也有重大隐患,可能会增加患癌症和血液疾病的风险[2]。
比如,参与研究时73岁的哈里特·布朗(Harriet Brown),她的端粒非常长,但她的脖子和喉咙里有良性的副神经节瘤,同时还患有甲状腺癌和两个黑色素瘤,而且还有CHIP(一种与心脏病和血癌相关的血液病)。
总结来看,端粒太短或太长都不利于人体的健康。太短与衰老以及衰老相关疾病、癌症有关,而太长也会增加患某些癌症的风险[3]。借用阿曼纽斯的话说:“衰老生物学比我们预期的要复杂得多,长端粒绝非永葆青春的秘诀。”
我们真的要让端粒慢下来吗?
我们不想让端粒无止境的长,但我们是不是可以让端粒慢点变短?
东非地区的洞穴里,有一种在我们看来非常丑陋的动物。它们只有8-10厘米长、眼睛很小、腿很短——甚至连名字都很难听:裸鼹鼠(Heterocephalus glaber)。

但这种啮齿类的小动物有一种非常独特的能力:长寿。它们比大部分啮齿类的寿命都要长10倍,换算成人类寿命的话,相当于是老鼠界的“百岁老人”。
裸鼹鼠也是目前科学家们探寻长寿秘诀的重要途径之一,而它们的其中一个秘籍,就是很会保护自己的端粒。
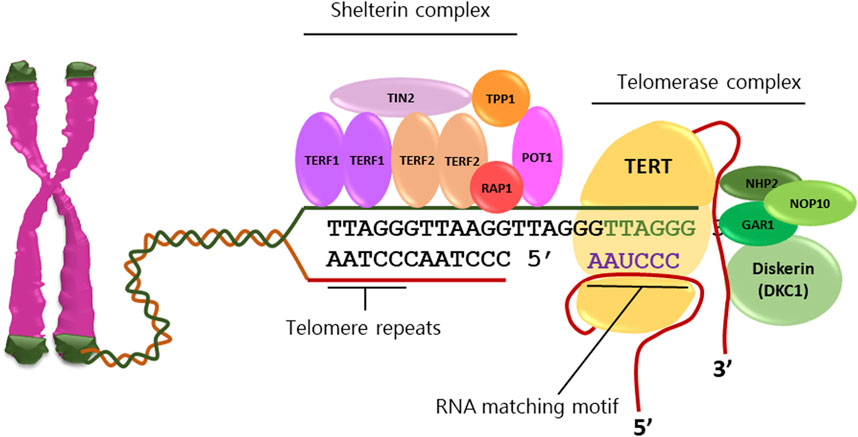
在生物体内,有一种被称为端粒酶的物质。它的作用就是把DNA复制损失的端粒填补起来,使端粒修复延长,从而增加细胞的分裂次数,减缓衰老进程。
裸鼹鼠很会利用端粒酶保护自己。然而,端粒酶在人体正常体细胞中活性却很低,起不到什么作用,但在生殖细胞、干细胞以及约85%的癌细胞中,端粒酶的活性都维持在较高水平,从而保证了这些细胞具有无限增殖的潜力[6]。
经过科研人员对端粒酶的多年研究,他们发现,Tert基因是干预衰老的一个很有希望的靶点,它的蛋白产物是组成端粒酶的结构之一,对端粒的复制至关重要,但在体细胞中几乎检测不到这个基因的表达,而其他基因的表达并没有发现异常。也就是说,端粒酶活性与Tert基因的表达有直接关系。
基于这一发现,科研人员们展开了大量实验。有研究表明,在1岁龄或2岁龄小鼠中注射Tert基因相关蛋白,可延迟年龄相关病变的发生,并分别延长其寿命24%或13%;另一项研究称,通过鼻内或腹腔给18个月龄小鼠注射表达TERT的小鼠巨细胞病毒(使小鼠体内大量表达Tert基因),每月1次,连续6个月,小鼠平均寿命延长41.4%[7]。
不妨大胆设想一下,如果在人体细胞中可以刺激端粒酶的活性,那细胞就可以无限复制,“长生不老”也可能不再是梦想。
事实是,经过上万年进化,我们的细胞并没有选择这么做,甚至于我们“聪明”的身体还要抑制端粒酶的活性。为什么会这样?难道生物不应该都希望长寿吗?
那是因为如果纵容DNA复制,就有很大的概率会导致细胞的恶性分裂,最终导致癌症的发生。因此,机体之所以抑制Tert基因的表达,很可能是为了减少体细胞癌变的风险。
目前来看,刺激端粒酶活性、延缓端粒损伤仍需一个度,控制好了就可以完美进行衰老干预或纠正退行性变化,一旦失控也可能引发更严重的后果。
也不是没有办法,但要付出努力
只要信心不滑坡,办法总比困难多。实际上,一些生活方式的改变,完全可以起到延缓端粒缩短的效果。长寿之家Changshou.com也会一直为你持续分享此方面的最新进展。
要解决问题,我们需要先弄清楚哪些因素可能会影响端粒的长度?
影响端粒长度的因素可分为内因和外因[1,4,5]。内因包括种族、遗传、年龄、性别、不同组织器官、细胞分裂、氧化应激与DNA损伤、感染和炎症、疾病(如自身免疫综合征、2型糖尿病等);从外因角度看,吸烟、饮酒、缺乏体育锻炼、暴露于污染中、不健康的饮食、精神压力大、熬夜、肥胖等都会导致端粒加速损伤。
因此,为了保护端粒并降低衰老速度,上述影响因素中能人为干预的,我们最好还是自己控制一下,至少也要做到以下几点:
请务必远离烟和酒;
日常生活中,可以通过少吃、多动、练习冥想,以保持身材和好心情,同时减少疾病的发生;
早睡早起,或者保持睡眠规律,每晚睡觉时间在7-8个小时左右;
饮食中加入抗氧化剂(比如富含维生素C和维生素E的食物)、膳食纤维、大豆蛋白和健康脂肪(比如牛油果、鱼和坚果中的欧米伽-3多不饱和脂肪酸)。

每个人都希望能活得更长一点,只不过有人靠遗传,有人靠自律,还有人靠科技,而寿命的长短并不是由单一因素控制的。
从DNA到端粒,从遗传到生活方式,我们已经发现了很多能延长寿命的线索,却也深知它们盘根错节、相互影响。
唯有整合各方力量,将先天优势、自我管控与科技助力协同起来,才能保护自己的端粒,延长健康寿命。
参考文献:
[1] Shammas, M. A. Telomeres, lifestyle, cancer, and aging. Current Opinion in Clinical Nutrition & Metabolic Care, 2010;14(1),28–34.
[2] News: Link Between Long Telomeres and Long. . . (The New York Times) - Behind the headlines - NLM. (n.d.). NCBI.
[3] Tsatsakis, A., Oikonomopoulou, T., et al. Role of telomere length in human carcinogenesis (Review). International Journal of Oncology, 2023;63(1).
[4] Turner K, Vasu V, Griffin D. Telomere Biology and Human Phenotype. Cells, 2019;8(1):73.
[5] Demanelis K, Jasmine F, Chen LS, et al. Determinants of telomere length across human tissues. Science, 2020;369(6509).
[6] Schmidt JC, Cech TR. Human telomerase: biogenesis, trafficking, recruitment, and activation. Genes & Development, 2015;29(11):1095-1105.
[7] Cai Y, Song W, Li J, et al. The landscape of aging. Science China Life Sciences, 2022;65(12):2354-2454.
